Известно, что биологические материалы такие как интактные эмбрионы, при обычных условиях подвержены изменениям и разрушению. Использование низких температур для длительного хранения зародышей повсеместно востребованный биотехнологический метод. Доказано, что при достижении критической температуры, известной также как температура «стеклования» составляющая -130°C образец может храниться неопределенно долгое время при практически полном отсутствии биохимических процессов.
Сохранение зародышей столь долгое время открывает для исследователей широкий спектр возможностей и позволяет создавать обширные хранилища «эмбриобанки» где могут храниться десятки тысяч эмбрионов редких и исчезающий пород, так и видов животных. Что позволяет проводить как фундаментальные исследования, а также сохранять и восстановить генетическое разнообразие.
Развитие зародыша в искусственной среде имитирующей жидкости яйцевода к сожалению, не в полной мере обеспечивает потребности зародыша в макро и микроэлементах, витаминах и аминокислотах. Известно, что эмбрионы, полученные методом in vitro обладают более низким функциональным статусом. Клеточная масса эмбриобласта и трофобласта ниже чем у эмбрионов, полученных классическим методом in vivo. В следствии чего эмбрионы более восприимчивы к крио повреждениям и требуют применения более деликатных методов криоконсервации позволяющих гарантированно сохранить качество эмбриона.
В связи с чем для определения оптимального протокола и метода заморозки нами были проведены ряд опытов по сравнению методов крио консервации, а также растворов криопротекторов.
Для опыта использовали доимплонтированные эмбрионы КРС полученные из ооциткумулюсных комплексов. Ооциткумулюсные комплексы извлекали прижизненно методом TAU (транс вагинальной аспирации) из антральных фолликулов яичников коров доноров. Поиск и морфологическую оценку осуществляли на стереомикроскопе лабораторного класса, Olympus SZ51 при 16 кратном увеличении. Для дозревания ооцитов использовали среду 199 (Medium 199, Hepes modification, 25mM.) с добавлением 10% эстральной сыворотки крови крупного рогатого скота, Na-пирувата, BSA, 1.0 ЕД / мл лютенизирующего гормона, 10 ME/мл, фолликулостимулирующего гормона, 1,0мкг / мл эстрадиола (спиртовой раствор) и 50 мкг / мл гентамицина.
Для оплодотворения использовали среду Fert-TALP и разделённое по полу криоконсервированное семя быков. Для оплодотворения яйцеклетки перемещались в лунки со средой объёмом 80 мкл. И инкубировались совместно со сперматозоидами в течении 18-20 часов при температуре 38,5-39 в атмосфере с содержанием 5 % CO2. После оплодотворения зиготы отмывали в растворе SOF и механически удаляли клетки кумулюса посредством пепетирования при помощи наконечников для денудации ооцитов диаметром 135 мкм. Очищенные зиготы помещались в среду на основе SOF c добавлением BSA, MEM vitamins, MEM Niaa, MEM iaa в лунки планшетов объёмом 500 мкл, покрытые минеральным маслом ( Sigma ,США) и культивировали при температуре 38,5º С в увлажненной атмосфере под газовой фазой (по 5% CO2 и O 2 и 90 % N2) в течение 7-8 суток. Для опыта использовали эмбрионы только отличного качества находящихся на стадии развития от BL-II ( поздняя бластоциста) до BL-IV (полностью Экспандированная Выход доимплонтированных бластоцист от числа поставленных на созревание яйцеклеток составил 29,42%
Криоконсервация опытных образцов осуществлялась на штатном замораживателе фирмы «CRYOLOGIC» модель CL 5500

Рис 1
И при помощи готовых наборов криопротекторов для витрификации фирмы «Криотек». Насыщение эмбрионов криозащитными растворами проводили по следующей ссхеме.
Таблица 1
|
№ п/п |
Наименование крипротектора |
Кол-во ступений насыщения |
Время насыщения Мин. |
Носитель |
№ программы
|
Способ криоконсервации |
|
1 |
EG-1,5 М |
1 |
10 |
Пайета 0,25 мл |
1 |
CL5500 |
|
2 |
EG-1,8 М |
1 |
10 |
Пайета 0,25 мл |
1 |
CL5500 |
|
3 |
GL-1,4 М |
2 |
15 |
Пайета 0,25 мл |
1 |
CL5500 |
|
4 |
EG-DMSO |
2 |
13 |
криотоп |
- |
витрификация |
Для криоконсервации эмбрионов 1, 2 и 3 группы использовали программу где начало охлаждения идёт с + 20˚С, охлаждение ведётся со скоростью 2˚С/мин. до -6 ˚С далее индукция кристаллизации и выдержка при этой температуре в течении 10 мин, далее охлаждение до -35˚С со скоростью 0,5˚С/мин. После завершения цикла заморозки пайеты с эмбрионами переносились в жидкий азот и хранились при температуре -196ºС.
Четвёртая группа замораживалась витрификацией где в качестве криопротектора использовали стандартный раствор фирмы «Криотек»
Насыщение эмбрионов криопротектором осуществляли по схеме, приведённой на Рис. 2
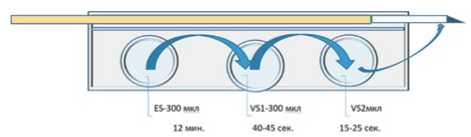
Рис 2. Схема насыщения эмбриона криопротектором для витрификации
После проводки в растворе криопротектра эмбрион помещался на носитель «криотоп» и погружался в жидкий азот (N2).
Оттаивание пайет с эмбрионами 1,2 и 3 групп производилось в водяной бане при температуре +37ºС. Эмбрионы криоконсервированные методом витрификации оттаивались по схеме, представленной на рис. 2
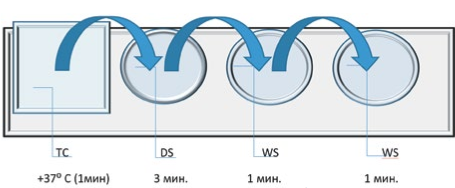
Рис.3 Девитрификация эмбрионов
Морфологическая оценка производилась на стереомикроскопе Olympus SZ 51 при 40 кратном увеличении. Эмбрионы оценённые как пригодные после выведения криопротектора помещались с среду SOF.
Таблица 2 Результаты испытаний
|
№ п/п |
Кол-во бластоцист |
Метод криоконсервации |
Наименование криопротектороа |
Кол-во пригодных после оттаивания n-% |
|
|
1 |
96 |
програмная |
EG-1,5 М |
67 |
69,50% |
|
2 |
84 |
програмная |
EG-1,8 М |
50 |
59,44% |
|
3 |
93 |
програмная |
GL-1,4 М |
68 |
71,03% |
|
4 |
77 |
витрификация |
EG+DMSO |
75 |
97,40% |
Исходя из данных Таблицы 2 можно сделать вывод, что наилучший результат сохранности показали эмбрионы 4 группы крио консервированные витрификацией из 77 замороженных эмбрионов 75 получили оценку как пригодные, что составило 97,40%. Наименьший результат сохранности показали эмбрионы крио консервированные в 1,8 М этиленгликоле, что составило 50 пригодных эмбрионов или 59,44%. Эмбрионы замороженные в 1,5 М этмленгликоле и 1,4 М глицерин заняли промежуточное положение.
Выводы:
Основываясь на результатах проведённых исследований можно сделать вывод, что метод витрификации позволяет достигать минимальных потерь при заморозке эмбрионов и составил 2,6 %. На данный момент ведутся работы по разработке системы витрификации на прямую пересадку.







